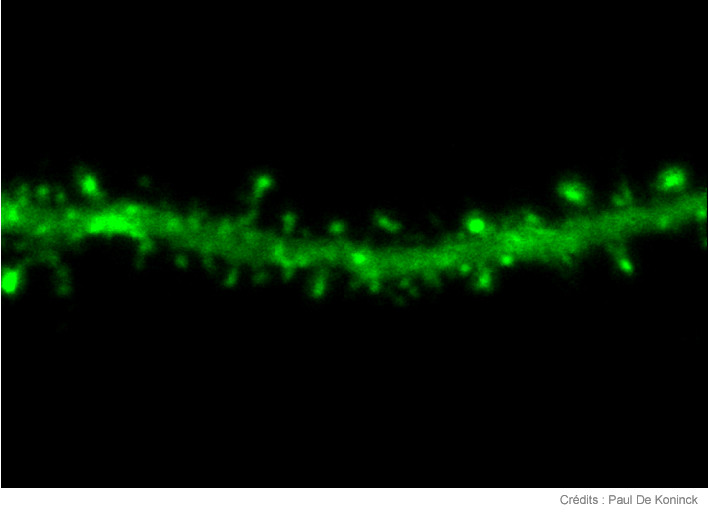
Voici une dendrite, une parmi tout ce réseau "d'écoute" prolongeant le neurone. Partout à sa surface, les épines captent les messages chimiques en provenance de neurones "émetteurs". Ce que nous vivons à l'échelle psychosociale est ainsi décortiqué à l'échelle moléculaire, pour être mémorisé, entièrement, partiellement, ou pas du tout.
À la lecture du présent article, des connexions unissant quelques-uns des 100 milliards de neurones de votre cerveau seront consolidées. Peut-être alors vous souviendrez-vous longtemps d’une enzyme essentielle à ce processus de mémorisation. La Calcium-Calmoduline-dépendant Kinase II, ou, pour les intimes, CaMKII. En ce moment, elle travaille fort pour que vous ne l’oubliez pas! Elle est en train de décoder l’activité électrique pour que les mots que vous êtes en train de lire laissent des traces tangibles – et plus ou moins permanentes – dans l’architecture de vos synapses, ces 10 000 points de connexion présents sur chacun des neurones. Elle a toujours fait ce décodage : pour vous apprendre à dire « papa » et « maman », vous aider à comprendre le français et les mathématiques, vous permettre de retenir la date d’anniversaire de votre douce moitié et, en fin de compte, faire de vous une personne unique… et inoubliable!
Des connexions plastiques
Le phénomène par lequel les connexions neuronales se modifient, selon les aléas de nos expériences et de l’environnement, se nomme plasticité synaptique. Notre capacité d’apprendre et de mémoriser de nouvelles informations dépend donc de ce qui se passe à l’échelle de la synapse, cette zone de communication entre deux neurones.
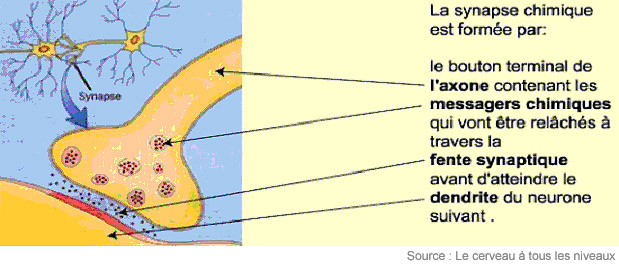
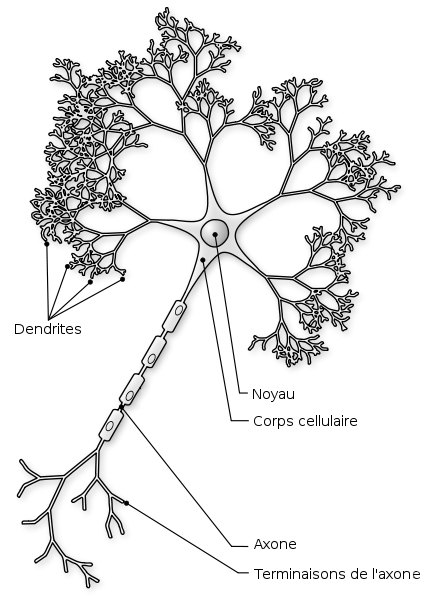
Il y en a deux types de synapses, distincts par leur signal : électrique ou chimique. Nous nous attarderons ici à la synapse chimique située à la terminaison axonale, ou bouton synaptique, d’un neurone « émetteur ». Ce bouton libère des molécules messagères appelées « neurotransmetteurs ». Le neurone « récepteur » capte ces messagers chimiques sur ses épines dendritiques, logées sur les dendrites, ces « branches » du neurone conduisant l’information reçue jusqu’au corps cellulaire.
Une grande découverte
On connaît le rôle essentiel de la CaMKII dans la plasticité synaptique depuis les années 1990. On sait, par exemple, que les rats dépourvus de cette enzyme ne mémorisent pas de nouvelles informations. Mais pour effectuer des percées utiles dans la recherche biomédicale, il ne suffit pas de savoir grosso modo si une molécule est importante ou non pour une fonction générale. Si vous annoncez à un biologiste moléculaire que vous avez lu un article affirmant qu’une protéine est bonne pour la mémoire, il vous regardera d’un drôle d’air en attendant la suite ou vous submergera de questions : Quelle molécule fait quoi? Avec qui? Comment? Où et quand?
Certains de ces mécanismes sont déjà connus. On sait que la CaMKII est responsable au sein du neurone de moduler l’activation de plusieurs protéines, dont notamment les récepteurs NMDA et AMPA (les « oreilles » à l’écoute des neurotransmetteurs du neurone voisin). Mais voilà qu’un nouveau mécanisme vient d’être mis au jour. Rien de moins qu’une grande découverte de l’équipe de scientifiques en neurobiologie cellulaire et moléculaire du Centre de neurophotonique du Centre de recherche de l’Institut universitaire en santé mentale de Québec. Le Dr Paul De Koninck et sa doctorante Mado Lemieux (dont c’était le sujet de thèse), Simon Labrecque, Christian Tardif, Étienne Labrie-Dion et Éric Lebel viennent de publier un article à ce sujet dans le Journal of Cell Biology1. Cette découverte dévoile un aspect fascinant de notre extraordinaire machinerie neuronale réglée au quart de tour, qui ferait passer pour des protozoaires nos ordinateurs les plus performants!
Cette découverte répond à la question suivante : comment une synapse, spécifiquement activée à un moment donné, reçoit-elle le matériel protéique dont elle a besoin pour être renforcée? Ce matériel provenant de la dendrite adjacente ou même du corps cellulaire, distants de plusieurs micromètres (des kilomètres, pour des structures aussi petites que les épines dendritiques!), comment peut-il être livré à la bonne synapse? Qui gère la livraison et comment?
Cette question aussi fascinante qu’essentielle titille les neurobiologistes depuis des décennies. Certains ont même désigné cette énigme comme une des quêtes du St-Graal de la neurobiologie. En effet, il s'agit d'une question d’une importance capitale. Des problèmes de livraison signifieraient que vous pourriez cesser d’apprendre toute nouvelle information… et que tout le monde se demanderait pourquoi vous avez l’air de sortir d’une autre époque.
Les chercheurs ont ainsi démontré pour la première fois que la CaMKII se déplace et se concentre dans les dendrites, juste en dessous de l’épine dendritique, là où elle intercepte des protéines voyageant sur les rails du neurone, les microtubules, pour leur signifier : «Eh! Stop! Cette épine dendritique vient d’être stimulée, dirigez-vous vers elle, il faut renforcer l’architecture de cette synapse!»
Trop beau pour être vrai
Lorsque Mado Lemieux et Paul De Koninck ont vu apparaître, sous les objectifs de leurs microscopes à fluorescence, la « translocation » dendritique de l’enzyme la plus abondante du cerveau, c’était presque trop beau pour être vrai. Là juste en-dessous d’une synapse, l’enzyme est demeuré quelques temps à cet endroit pendant la stimulation, puis elle a disparu. De plus, au moment de la stimulation, le calcium oscillait rapidement exactement au même endroit. En fait, le calcium, messager cellulaire par excellence, répétait à notre enzyme de se pointer au plus vite, et elle obéissait à la microseconde, au nanomètre de dendrite près.
L’enthousiasme était à son comble : la CaMKII était prise sur le fait, en train de jouer un rôle longtemps soupçonné mais jamais prouvé. Les chercheurs ont non seulement prouvé que la translocation dendritique de la CaMKII jouait ce rôle d’aiguillage indispensable dans la plasticité synaptique, mais ils ont en plus élucidé une partie du mystérieux mécanisme moléculaire qui permet ce déplacement.
De fait, lorsqu’une synapse est activée par un neurotransmetteur, la concentration de calcium augmente sous forme d’oscillations rapides (vidéo 2). Cette concentration, dont l'intensité et le rythme varient, se produit sous cette synapse et agit en tant que « messager » cellulaire pour recruter la CaMKII, exactement à ce hot spot.
Ces oscillations du calcium sont en fait une forme de code, un code calcique : un langage cellulaire, un code morse essentiel au réseau neuronal, un code qu’on cherche à identifier depuis des décennies dans les labos à l’échelle internationale. Et quand on le décodera, je vous jure que ce sera pour la science un moment aussi historique que le moment où Champollion a déchiffré les hyéroglyphes égyptiens!
Un premier déchiffrage de cette pierre de Rosette vient d’être réalisé grâce à Paul De Koninck et Mado Lemieux. Ils ont démontrés que la CaMKII préfère se déplacer exclusivement sur les hautes fréquences d’oscillation du calcium. Vous en souviendrez-vous? Le calcium ne sert pas qu’à sécuriser les routes l’hiver et salir vos bas de pantalon! Il rend vos os plus forts, mais aussi vos synapses, si la CaMKII est de la partie, et bonne nouvelle pour nous, elle y est.
VIDÉO 1 : CaMKII en translocation
On observe ici la translocation dendritique, soit le déplacement et la concentration de l'enzyme CaMKII sous une synapse et ce, sous l’effet d’un neurotransmetteur.
La biophotonique, technologie hybride entre physique et biologie, utilise les propriétés de la lumière. On observe alors en temps réel des phénomènes moléculaires, tel ici l'action de l'enzyme CaMKII. Le défi est de taille. À cause de la petitesse des surfaces étudiées, mais aussi de l’encombrement causé par des milliers de molécules se chevauchant. Comment reconnaître la CaMKII au beau milieu de cette congestion? La solution : lui apposer génétiquement un certificat d’identité qui devient fluorescent à une longueur d’onde donnée.
Au début de cette vidéo, la CaMKII est diffuse sur tout le neurone, parce que la transmission synaptique est bloquée chimiquement. Puis, on retire ce blocage et peu après, on aperçoit quelques points plus brillants, au fur et à mesure que la CaMKII s'y concentre.
Les deux images montrent le même neurone au même moment, mais filmé en éclairant deux choses différentes. À gauche : CaMKII. À droite : la concentration de calcium. Plus la couleur est froide (bleu-mauve), moins la concentration est forte. Plus elle est chaude (rouge, maximum : blanc), plus la concentration est forte.
Observez les endroits de la dendrite indiqués par les flèches. Au moment où la transmission synaptique débute, remarquez (à droite) que le calcium oscille (flashs rapides) comme un feu d’artifice. Repérez les endroits correspondants (flèches) sur l’image à gauche, et vous verrez que la CaMKII se concentre aux mêmes endroits dans la dendrite.
VIDÉO 3 : CaMKII sur les rails
Pour se regrouper sous les synapses actives, la CaMKII s’accroche aux microtubules. Ces rails parcourent les dendrites pour rejoindre le centre de la cellule. La compréhension de ce mécanisme est au cœur de la découverte de Paul De Koninck et de Mado Lemieux.
La juste mesure de la question synaptique
Évidemment, en science, l’enthousiasme ne peut aller sans la rigueur : des années d’expérimentation biochimique et de tests statistiques ont suivi cette première observation de la translocation de cette enzyme mémorable, dans une dendrite de neurone. Et cette observation vient confirmer que la CaMKII joue un rôle essentiel dans un processus nommé synaptic taging and capture. De fait, elle agirait comme aiguilleur, à la base des épines dendritiques, afin que le matériel protéique transporté sur les microtubules soit intercepté et relâché à la bonne synapse.
Pour que ce scénario soit plausible, il fallait démontrer que cette translocation locale de la CaMKII aux dendrites agissait effectivement sur la plasticité des synapses. Ce phénomène devait être associé à une modification mesurable. Ainsi, Paul De Koninck et Mado Lemieux ont d'abord vérifié si la CaMKII était dans sa forme active quand elle se déplaçait vers cette base stratégique, sous l’épine dendritique. Le test fut positif : oui, l’enzyme est active. Voilà un indice incontournable montrant bien qu’elle « fait quelque chose », pas n’importe où, pas n’importe quand, mais bel et bien aux microtubules dendritiques juste sous une synapse qui vient d’être stimulée.
Ainsi, la « dynamique spatio-temporelle » de la CaMKII, en tango féroce avec le rythme saccadé du calcium, indique que l’enzyme se positionne bien sous les synapses accrocs à la stimulation, mais qu’en plus elle se réveille pour faire son travail d’enzyme, c’est-à-dire influencer le comportement d’autres protéines. Car bien souvent la CaMKII peut être inactive.Si on l’avait trouvée à « dormir », même située à la base des synapses, on aurait pas donné cher pour ce fameux rôle de synaptic tag. Heureusement, ce ne fut pas le cas.
Le renforcement synaptique
L’équipe de recherche a aussi vérifié si la translocation dendritique avait un impact sur deux paramètres cruciaux du renforcement synaptique : le nombre de récepteurs à neurotransmetteurs de type AMPA à la synapse et le remodelage des synapses.
D’abord, on a voulu savoir si la translocation locale de la CaMKII influait sur le nombre de récepteurs AMPA à la synapse. On sait qu’un des moyens pour une synapse d’augmenter sa force est d’accroître le nombre de ces récepteurs, parce que cela amplifie sa réactivité aux neurotransmetteurs.
Cette mesure devait être prise sur des structures de quelques micromètres, soit l’équivalent d’un cheveu coupé en dix. Encore une fois, les chercheurs ont fait usage de la biophotonique. Ils ont fait exprimer au neurone le gène de la CaMKII auquel était ajouté une séquence d’ADN codant pour une molécule fluorescente (fluorophore) détectable au microscope exclusivement sur la longueur d’onde du rouge.
Dans le même neurone, avec l’aide du spécialiste des récepteurs AMPA du laboratoire, le doctorant Simon Labrecque, ils ont couplé au fameux récepteur à neurotransmetteur un autre fluorophore : celui-ci devenant vert uniquement lorsque le récepteur est inséré au bout de l’épine dendritique, prêt à « tendre l’oreille » pour recevoir les neurotransmetteurs relachés par le neurone voisin, et qui traverseront la synapse.
Résultat : en plein dans le mille! Les chercheurs ont eu l’agréable surprise de constater qu’ils avaient vu juste. Lorsque la CaMKII se décide, sous l’effet de la stimulation, à voyager en groupe hyperconcentré pour se placer juste sous l’épine dendritique, il se produit une augmentation massive et significative de l’insertion des récepteurs AMPA à la synapse.
Il semble donc que cette translocation locale joue bel et bien un rôle important dans la plasticité des synapses. Car, juste à côté de ces hot spots qui bouillent d’activité, si la CaMKII ne bronche pas, ce sera tant pis pour cette synapse voisine : il n’y aura aucune augmentation significative de l’insertion des récepteurs AMPA.
Ce n’est pas tout. Les chercheurs ont entrepris une autre série d’expériences dans le but de vérifier si la translocation dendritique de la CaMKII pouvait affecter le remodelage des synapses. Le résultat est stupéfiant! Non seulement peut-on voir, comme vous le verrez de vos yeux dans cette 4e vidéo, des épines dendritiques augmenter de volume, mais aussi de nouvelles synapses apparaitre dans les dendrites où notre sympathique et workaholic enzyme se concentre.
VIDÉO 4 : La translocation dendritique et son influence sur la plasticité
La translocation dendritique de la CaMKII joue ici sur la plasticité des épines dendritiques. Sur les deux images, c'est le même neurone.
- En haut : on suit les migrations de CaMKII dans la dendrite et vers l’épine dendritique.
- En bas : on observe les modifications dans le neurone. L’épine dendritique va-t-elle grossir? Eh oui!
Mais pour prouver que le regroupement de l'enzyme dans la dendrite à la base des synapses avait un rôle sur leur plasticité, il fallait prouver que c'était plus qu'une coincidence. Ils ont alors comploté un stratagème pour empêcher l'enzyme de se regrouper à cet endroit stratégique. Conséquence dramatique : la plasticité synaptique n'était plus présente. Cette démonstration fut l'une des clés pour prouver l'importance de ce comportement de l'enzyme pour la mémoire.
En résumé…
L’activité électrique et biochimique de votre cerveau à travers son réseau synaptique vous permet de sentir avec vos cinq sens, de mémoriser et d’apprendre. Et pour saisir cette action sur le vif, les outils qu’offre la biophotonique sont fabuleux, dépassant des frontières de visualisation microscopique jadis infranchissables. On explore alors en temps réel cette complexité plastique, se modifiant tout le long de notre vie.
À l’échelle cellulaire et moléculaire, la plasticité implique la restructuration, l’activation, l’interaction et le transport d’une multitude de protéines à la synapse.
À l’échelle cellulaire et moléculaire, la plasticité implique la restructuration, l’activation, l’interaction et le transport d’une multitude de protéines à la synapse. Sous l’influx d’une stimulation par un neurotransmetteur spécifique, des messagers ioniques tel le calcium pénètrent à travers la membrane cellulaire d’un neurone et enclenchent une cascade de réactions en chaîne moléculaires conduisant soit au renforcement de la synapse entre deux neurones, soit à son affaiblissement. L’ion calcium « communique » sous forme d’oscillations dynamiques dans sa concentration : beaucoup, pas beaucoup, beaucoup, pas beaucoup.. Ce langage est fait de hautes ou de basses fréquences, dont l’intensité et l’étendue varient dans le temps et l’espace (du neurone, bien sûr), un code morse précis… et vital. Le Dr De Koninck et l’équipe de son laboratoire viennent donc de découvrir les talents de ce traducteur expert du « code calcique » en prouvant que la CaMKII décode ses hautes fréquences, pour ensuite entreprendre sa translocation aux microtubules des dendrites et accroître la force des synapses ou en créer de nouvelles. Tout indique que cette molécule agirait comme synaptic tag. Un étiquetage servant à reconnaître la synapse stimulée qui mérite qu’on lui apporte son cargo de protéines pour que la force synaptique soit avec elle.
...et en conclusion!
Comprendre ces mécanismes impliqués dans la plasticité synaptique constitue un enjeu majeur dans la recherche fondamentale sur le cerveau et sur plusieurs maladies neurologiques ou mentales, tel les troubles de l’apprentissage, la maladie d’Alzheimer ou la schizophrénie. Alors là, tentez, sans tricher, de nommer cette enzyme qui travaille si fort pour vos neurones. Oui, félicitations : Calcium-Calmoduline-dépendante Kinase II. Surtout, rappelez-la… à votre mémoire, et à votre santé!
Note :
- 1. Lemieux M, Labrecque S, Tardif C, Labrie-Dion É, Lebel É et De Koninck P (2012). "Translocation of CaMKII to dendritic microtubules supports the plasticity of local synapses", Journal of Cell Biology. 198 (6): 1055-73.
- Nikolas B.-L. Bernier
Université Laval
Nikolas B.-L. Bernier est détenteur d’un baccalauréat en biologie (concentration biologie cellulaire et moléculaire) de l’Université Laval. Après un stage de recherche à l’unité de génétique humaine du Centre recherche du CHUL, il se joint en 2009 à l’équipe du laboratoire de Paul De Koninck au Centre de recherche de l’Institut universitaire en santé mentale de Québec. Il y entreprend une maîtrise en neurobiologie portant sur le décodage des signaux calciques intra-neuronaux par l’enzyme CaMKII et la protéine Rem2. Ses travaux ont contribué à une publication (PLoS ONE, juillet 2012). Il est également rédacteur, concepteur éducatif et animateur scientifique pour La Bibitte mobile, une entreprise de vulgarisation de la biologie, ainsi que rédacteur-traducteur pour la galerie d’art de Baron Lafrenière avocats. Il écrit en ce moment un spectacle visant à faire connaître au grand public l’histoire des sciences et l’actualité scientifique de la ville de Québec. Crédits pour les 4 vidéos© 2012 Lemieux et al. Rockefeller University Press. Originally published in J.Cell Biol.198 :1055-1073. doi:10.1083/jcb.201202058
Vous aimez cet article?
Soutenez l’importance de la recherche en devenant membre de l’Acfas.
Devenir membre